<2006/4:本稿を追加、2011/01:加筆修正>
「再発(再燃)がん」および「骨転移」に関する項は米国のCIN(Cancer Infomation Network:がん情報ネットワーク)の関連サイト”CancerConsultants.com” 内のページ
「前立腺がんの治療と予防」をベースにしましたが、他の信頼できうる情報も多く取り入れ、内容をより充実させたつもりです。
米国事情と国内事情が大きく異なる部分には注記を入れてあります。
このページに関しては、「がん情報サービス」を始め国内医療機関のホームページや一般向けの解説書よりはかなり詳しいはずですが、
もし、内容に明らかな間違いがあると思われる場合は「ひげの父さん」までご一報ください。
■ 転移がん
N1M1、N1M0、N0M1 および病期T4の全て(D1,D2)がこれに含まれます。
現在の医療レベルでは残念ながら完治は望み薄です。
ただ、小さなリンパ節転移のみがある場合には、リンパ節転移の位置や個数にも寄りますが、
治癒の可能性もまだ残されています。
全国のがん専門病院30施設よりなる全がん協の調査データによれば、
限局がん、局所浸潤がんの5年生存率は、今やほぼ100%とされていますが、
転移がんに関しては、かなり厳しく、せいぜい50%程度という状況です。
しかしながら、転移がんの患者さんの中にも、長期間(10数年)
がんと共存しながらQOL(生活の質)を
維持しておられる方が居られますので、あきらめないことが肝要です。
ただ、特に厳しいのは、骨関連事象(骨痛、神経圧迫、圧迫骨折等)を伴う骨転移がある場合で、
こうした場合は5年を超える生存は一般的に難しいと言われています。
がんが散らばっている以上、局所療法としての全摘手術や放射線治療はもはや意味をなさず、
全身療法としての薬物療法(内分泌療法や化学療法)が選択肢となりますが、
薬物療法の詳細に関しては統一されたガイドラインはなく、治療法は医療機関、担当医師によって異なるのが実情です。
内分泌療法のファーストラインとしては、近年、LH-RHアナログ単剤よりも、非ステロイド系の抗男性ホルモン剤
(カソデックスが用いられることが多い)を同時併用するMAB(Maximum Androgen Blockade)療法が主流となりつつあります。
(注:MAB療法はCAB(Combined Androgen Blockade)療法とも呼ばれています)
MAB療法に反応しなくなっても、「次の手」はまだいくつかありますので、主治医と良く相談の上、
どのような手順でどの治療法を選択するかが、がんとうまく共存し、QOLを保って生き抜くための重要なポイントとなってきます。
「次の手」の詳細は、別項「薬物療法のあの手この手」をご覧ください。
<主な標準治療>
・ホルモン療法
・ホルモン療法+放射線外部照射
■ 再発(再燃)がん
外科的手術や放射線療法の後(ホルモン療法併用の有無は問わない)、PSAの上昇などにより再び前立腺がんが検知された場合、
それらは「PSA再発」と呼ばれます。PSA再発に関しては統一された定義はありませんが、PSAの上昇具合(3連続上昇等)を見ながら、
一定の閾値(カットオフ値)を超えた場合に、PSA再発とみなすことが多いようです。
外科的手術をした場合なら ”0.2”、こちらは比較的異論が少ないようですが、放射線治療だけをした場合には、
医療機関(医師)によって様々な定義があり、統一された閾値はありません。
国立がん研究センター「がん情報サービス」の解説(「再発」の項)によれば”1.0”となっていますが、どうやらこれは少数派の見解のようです。
「1.0説」は「診療ガイドライン」2006年版にも見当たりません。
実は他にも、”放射線治療後の最低値+2.0”、”前回値+2.0(or3.0)”、”0.5以上の上昇が2連続” など様々な説があります。
再発の閾値が「がん情報サービス」の言う”1.0”であれば、私はすでに「再発」していることなりますが、
現在主流の考え方は、放射線治療だけをした場合は ”最低値(nadir)+2.0” であり、私のかかる医療機関もこの考え方をとっています。
医療機関によって差があり、国立がん研究センターのサイトもあてにならないというのは、どうも納得がいかないのですが、
まあ、PSA再発の閾値というものは、元々その程度の意味しか持たないものだと割り切って考えたほうが良いのかもしれません。
今日では高感度PSAによる定期的なフォローが一般化しており、再発という場合には「PSA再発」を意味することが多いようです。
画像検査等で転移や新たな病変が見つかった場合を「臨床的再発」と言いますが、PSA再発から臨床的再発に至るまでの期間は
長短様々で、再発と言ってもすぐに生命の危険に結びつくわけではありませんが、リスクの高い再発として用心すべきなのは
次の場合だと言われています。
(1) PSAの倍加時間(ダブリングタイム)が6ヶ月以下である
(2) PSAの上昇幅が年間2.0を超える
こうした場合だと、将来遠隔転移が出現する可能性が高く、前立腺がんのために天寿を全うできない可能性も、
考慮に入れておく必要があるでしょう。
再発前立腺がんの治療法は、がんの進展度や、初めにどんな治療法を受けたかなど、様々な要因によって変わります。
治療を受ける目的や狙いは様々で、
・がんをとりあえず限局的に制御して症状改善を狙うのか、
・がんそのものの治癒を狙うのか、
・それとも延命を計ることを第一と考えるのか、
どのような治療を受けるにせよ、それによって生じるリスクと合わせ、慎重に比較検討しなければなりません。
ホルモン療法の継続にもかかわらずやがてその効果がなくなり、前立腺がんが再び勢いを盛り返してしまう場合、
これを再燃と呼び、この状態のがんを「再燃がん」もしくは「ホルモン耐性前立腺がん(HRPC)」と称しています。
以下は再発もしくは再燃前立腺がんの治療に関する一般的な説明ですが、これらの治療方法をどのように適用するかについては、
患者それぞれのがんの状況および予後の因子によって異なってきます。
* 最新治療法なるものは、ほとんどの場合、臨床試験が行われています。臨床試験とは実際に患者を治療しながら、
新薬あるいは新治療法の有効性を評価する研究を行うことです。
新治療法というものは多くのがん患者の協力によってそれが評価されることにより、
広く認知されてゆくものなのです。
臨床試験への参加は、患者にとって、よりよい治療に接する機会が得られると共に、
がんの治療に関するあなたの知識レベルをさらに高めてくれるかもしれません。臨床試験はがんのほとんどのステージで利用可能です。
もしあなたが臨床試験への参加に関心があるなら、臨床試験のリスクとベネフィットについて主治医とよく話し合われてみてはいかがでしょう。
がんの最新療法と臨床試験情報はあなたが最適な治療を受けるためには必要不可欠です。
* 注:これは米国事情です。臨床試験に関しては、日米間でかなり事情が違いますのでご注意ください。
再発(再燃)前立腺がんの治療法は、これまでの治療法および患者のあらゆる状態に配慮する必要があります。前立腺切除術を受けた後、
手術近傍の限局部のみの再発であるなら、放射線治療が可能でしょう。患者が前立腺全摘除術の後に、
前立腺あるいはその周辺への放射線治療を既に受けていたなら、再び身体の同一部位に放射線治療を施すことはできません。
検査により前立腺がんの転移が判った場合には全身治療であるホルモン療法ないし化学療法がそうした場合の典型的な治療法となります。
骨の痛みを和らげるため、放射線治療が施されることもあるでしょう。
前立腺がんがホルモン療法にもかかわらず成長し続ける場合、
すでに薬物に対する耐性を獲得してしまったことを意味し、こうした病状に対しては、研究段階の治療法は多いのですが、
残念ながら有効と明言できる治療オプションをほとんど持ち合わせていないのが現状です。
● 全摘除術後に再発した前立腺がん
全摘除術の後で、手術標本が断端陽性(がんが外科手術によって完全に除去しきれなかった証拠)を示す場合、
PSAが下がり切らなかった場合、あるいは、一旦下がった後にPSAが再上昇したような場合などで、
身体の他の部位にはがんが散らばっていないという予測が成立する場合は放射線治療をお勧めします。
放射線治療は近年目覚ましい進歩を遂げており、狙った範囲に集中的に高い線量を照射することができるようになりましたが、
この恩恵を被ることができるのは、実は放射線治療を第一選択とした場合に限られます。
すでに前立腺がんを撤去してしまった状態で、その近傍のどこかにがん細胞が残っているという状態に対しては、
高精度照射は意味をなさず、より低い線量をより広範囲に照射することしかできません。
それでも、がん細胞を死滅させることは可能ですが、高精度照射に比べれば線量が低いだけに効果も劣り、かつ照射範囲が広い分、副作用も大きくなってしまいます。
また、照射範囲内のがん細胞を死滅させることができたとしても、前立腺の近傍にがんが残っている場合はそれで良いのですが、
微小ながんがすでに離れた位置へ広がってしまっている場合にはまったく用をなしません。
術後救済療法として放射線治療を施された患者の75%は、放射線治療後5年以内に再度PSAの上昇に見舞われると言われています。
(注:この確率は米国のケースで日本ではもっと低いと考えられています)
グリソンスコアが高い、病期が進んでいる、PSA値が高い・・・要するにハイリスクな病状ほどその危険性も高くなるといえるでしょう。
すでに微小転移があるかどうかを事前に知ることは不可能ですが、
患者個々の病状を過去のデータの集積(パーティンノモグラム等)と照らし合わせて、ある程度の確率を予測することは可能です。
ただ、トータルな確率は予測できても、患者個人にとっては、成功か、無意味に終わるか、いずれかの結果しかありません。
術後の放射線治療に望みをかけても、成功する場合もあれば逆に無意味に終わるかも知れないこと、
治療を受けるためにはまたなんらかの生活上の不便さを我慢しなければならないこと、そしてたぶん被るであろうなんらかの副作用も
考慮した上で、総合的に判断し、今一度完治を狙い放射線治療に賭けるべきか、ホルモン療法を継続しがんとの共存作戦に切り替えるか、
あるいは臨床試験への参加を考慮すべきか・・・を決断すべきでしょう。
こうした判断をするにあたって、患者はそれらをもっと良く知るために必要な様々な情報の提示を受ける権利があります。
注:日本人の場合は前立腺がんの発生が欧米人に比べてはるかに少ないのと同様、微小転移の存在率もかなり低いと思われています。
国内のデータは見当たりませんが、術後救済照射によって完治する確立は、もっと高いことが予想されます。
● 放射線治療後に再発した前立腺がん
放射線治療後にもかかわらずPSAレベルの上昇が生じる場合、放射線治療の効果が限局部全体に及ばなかったのか、
始めから前立腺の外部に「微小転移」があったかのいずれかです。このような微小ながん細胞は、現在の画像診断技術では検知不能です。
一旦前立腺へ放射線照射を受けてしまえば、再度同じエリアへ放射線を照射することはできません。
放射線治療後も執拗に生き残ったがん細胞に対し、全摘除術あるいは局所凍結療法を用いることもありますが、あまり一般的とはいえません。
(注:日本では凍結療法はほとんど行われていません)
全摘除術および凍結療法の合併症は、先に放射線治療を行った患者においてより頻度が高い傾向があるので、
ほとんどの医師はこうした局所療法の追加にはあまり積極的ではないでしょう。
放射線治療後に再燃した前立腺がんの患者には、通常ホルモン療法が適用されます。
ホルモン療法とは前立腺がんが成長するのに必要な男性ホルモンを体からとりあえず奪ってしまう療法です。
限局がんであれ、転移がんであれ、前立腺がんがどこにあってもその成長を抑えることが可能です。
再発前立腺がんは、通常、ホルモン療法で一定期間(しばしば数年)コントロールすることができます。
しかしながら、ほとんどの前立腺がんはホルモン療法の継続にもかかわらず、ある時点以降再び成長し続けるはめとなってしまいます。
ホルモン療法は、外科的手術(睾丸摘出)による場合もありますが、多くは薬剤によります。
前立腺がんの成長を防ぎ、病状を改善することはできますが、根本的な治療法とは言えません。
ただ「期待しうる余命」との比較でホルモン療法でも十分と考える方もおられますし、他方、それでは不十分と考えて
再発前立腺がん向けの新治療法を評価する臨床試験への参加を希望される患者さんも少なからずおられます。
(注:日本では臨床試験への参加はあまり普及していないのが実情です)
● ホルモン耐性(再燃)前立腺がん:HRPC
前立腺がん細胞が成長するためには男性ホルモンを必要とします。ホルモン療法は、血液中の男性ホルモンのレベルを減少させ、
前立腺がん細胞をいわば仮死状態に追いやります。
前立腺がんは、多くの場合ホルモン療法で一定期間(しばしば数年)その活動を押さえ込むことが可能です。
しかしながら、ほとんどの前立腺がんは、結局のところホルモン療法の継続にもかかわらず勢いを盛り返して(再燃)しまいます。
ホルモン療法の効果持続期間は、低分化がん(グリソンスコア:GS=8~10)ほど短いと言われています。
ホルモン依存性であったがんが非依存性となる作用機序には様々な仮説がありますが、
精巣由来のアンドロゲンが枯渇すれば、一時的にホルモン感受性が高まり、副腎経由のアンドロゲンだけでも
がん細胞が生き延びられるようになるため、副腎経由のアンドロゲンも絶ってしまうことが重要となってきます。
それでもやがて、ホルモンを完全に断たれても、なお生き延びていけるだけの強力な「ホルモン耐性」を獲得してしまうわけですが、
こうなると比較的成長が遅いと言われている前立腺がんも、他部位の手怖いがんと同様、非常にやっかいな相手となってしまいます。
急速に勢いを増すがんが多く、従来は、前立腺がんがホルモン耐性を獲得してからは、数年程度しか生き残れないといわれて来ましたが、
近年はホルモン療法の工夫や新しい抗がん剤の登場により、全治療期間はこれまでよりはもう少し時間的余裕があると考えられるようになってきました。
その理由の一つは、進行前立腺がんにおいて、生存期間の延長が認められた唯一の抗がん剤ドセタキセル(タキソテール)が、
2008年より医療保険の対象となり広く使えるようになったことです。
ただ、我国ではまだ使用実績が乏しく、この抗がん剤の使用開始時期、使用法(単剤かステロイドとの組み合わせか)投与量等に関しては、
まだ模索が続いています。
ここから先、いかにして生活の質を保ちつつ、少しでも長くがんの進行を抑え続けるかが、
医療者の長年の研究課題となっていますが、決め手はなかなか見つかっておりません。
通常用いる内分泌薬や抗がん剤のすべてに耐性を獲得してしまったホルモン非応性前立腺がん(HRPC)に対する治療オプションは、
最新療法の評価研究を行う臨床試験を選択するか、(注:左記は米国事情で日本ではあまり普及しておりません)
前立腺がんに多く見られる骨関連事象への対処(ビスフォスフォネート剤や放射線の外部照射、体内照射等)、
症状緩和を目的とする薬物による緩和ケアなど、選択枝が限られてきます。
しかしながら、海外からは新たな医療情報も届いています。
前立腺がん治療ワクチン「プロベンジ」というのがその一つで、2010年、米国FDA(食品、医薬品局)の承認が得られ、
高額にもかかわらず米国での需要は多いとのこと。日本での承認はまだかなり先か。
参考:プロベンジ http://higepapa.blogspot.com/2011/01/blog-post_23.html
これ以外にも、近い将来、画期的な薬剤や治療法が出現する可能性も十分考えられるわけですから、
悲観するにはまだまだ早すぎます。しぶとく希望を持ち続け、最後まであきらめないことです。!
● 薬物療法のあの手この手
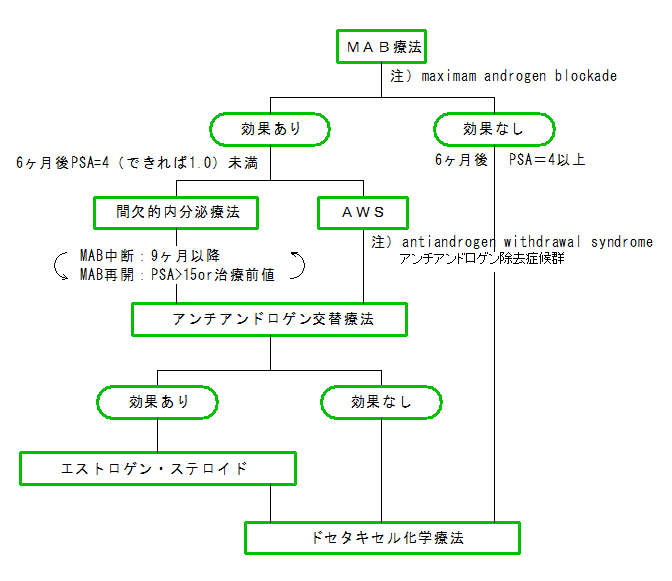
【MAB療法(一次治療)】
ホルモン療法のファーストラインとしては、LH-RHアナログ剤単独よりも、LH-RHアナログ剤(リュープリン、カソデックス)に抗男性ホルモン剤を併用する
「MAB」(maximam androgen blockade)療法のほうが多くなってきた。(ホルモン療法の70~80%)
LH-RHアナログ剤の相手としては、ステロイド系よりは非ステロイド系のほうが効果が高く、
非ステロイド系ではオダインで肝機能障害の懸念が強いため、カソデックスが最初に用いられることが多い。
【フレアアップ現象】
LH-RHアナログ剤は、LH(性腺刺激ホルモン)-RH(放出ホルモン)と似た作用を持つので、服用直後に、一時的に男性ホルモンを上昇させる作用があり、
投与後まもなく(1週間頃)症状などが悪化することがあり、これを「フレアアップ現象」と呼んでいます。骨転移(骨痛)を有する患者等には特に注意が必要です。
MAB療法を行う場合に、抗男性ホルモン剤を投与し、先にPSAを低下させてから、引き続きLH-RHアナログ剤を投与することが多いのはこのためです。
【アンチ(抗)アンドロゲン除去症候群:AWS】
ホルモン療法において、とりあえず一定の効果が得られていた場合には、まずは投薬の一時中止
(オダイン、プロスタールなら4週間、カソデックスなら8週間以上)によって、PSAが降下する現象「アンチアンドロゲン除去症候群」
(AWS:anti-androgen withdrawal-syndrome)の有無を確認する。
【アンチ(抗)アンドロゲン交替療法(2次治療)】
抗アンドロゲン剤を別種のものと取り替える 「アンチアンドロゲン交替療法」は必須です。
カソデックス(ビカルタミド:非ステロイド系)→オダイン(フルタミド:非ステロイド系)→プロスタール(酢酸クロルマジノン:ステロイド系)というのが
良くある流れ。
【エストロゲン(女性ホルモン)・ステロイド(3次治療)】
エストロゲン剤は、米国では、副作用(心血管障害)の恐れ、環境ホルモンへの懸念から、現在使用されておりません。
我国では、かつてホンバンなどの合成女性ホルモン剤が良く使われていましたが、製造中止となり、
現在使用可能なエストロゲンはプロセキソールとエストラサイトだけとなりました。
ステロイド(糖質コルチコイド)低用量投与は海外では確立された治療法とはなっていないようですが、日本では比較的多く用いられています。
デキサメタゾン(デカドロン)、プレドニゾン(プレドニン)などがその例です。
【間欠療法:IAS】
内分泌療法に対し反応性が良い(PSAがすぐに下がる)ことが絶対条件だが、間欠療法(IAS:intermittent androgen suppression)も
検討の価値がある。
生存期間の延長に対する優位性は証明されていないものの、千葉医療センターにおける臨床試験の結果報告(Urology View vol.7 2009)では、
75ヶ月経過時点のPSA非再燃率は、間欠投与85%に対し、持続投与は60%。間欠療法のほうが有意にすぐれているというデータです。
間欠療法は、休止期間中のQOLの改善、ひいては医療費の軽減にもつながります。
原則として9ヵ月以上ホルモン療法(MAB)を続けてから、MABを中止、再開時期はPSA値を指標にし(PSA=10~15?)、これを繰り返します。
投与再会後6ヵ月でPSAが1.0以下となり、9ヵ月までに最低値に達することが理想。
【タキソテール(ドセタキセル)】
タキソテールは前立腺がん患者の生存期間を有意に延長することが明らかになり、米国では2004年に承認、
日本では2008年8月に承認されました。
従来、良く用いられてきた「ミトキサントロン/プレドニゾン」療法と、
新しい「タキソテール/プレドニゾン」療法を直接比較した治験の結果、タキソテールを用いたグループ方が、
延命効果と疼痛軽減効果において「ミトキサントロン/プレドニゾン」グループより優れていることが判明しました。
タキソテールがエストラムスチンと組み合わせて用いられる場合にも、プレドニゾンと同様の延命効果が認められています。
容量、用法(併用薬剤)、開始時期、継続期間についてはまだ統一された見解はありません。
我国の場合、用法で一番多いのは、エストラムスチンとの併用、次に多いのがタキソテール単剤(3週毎)ですが、
「PSA効果」、「無増悪期間」で成績が良いのは「タキソテール、エストラムスチン、カルボプラチン」の3剤併用で、これは副作用(有害事象)も比較的少ない。
タキソテールの容量は海外では75mg/㎡が標準だが、我が国では副作用への懸念から70mg/㎡以下とする場合が多い。
副作用で多いのは、白血球(好中球)減少と末梢神経障害。重篤な障害としては間質性肺炎があるが頻度は少ない。
治療初期には一時的にPSAが上昇するフレアアップ現象が見られることもある。
● 薬物療法の手順
進行前立腺がんに対する薬物療法の手順は、ガイドラインとして確立されているわけではありません。
医療機関あるいは主治医によって判断は様々ですが、比較的新しいと思われる考え方を示しておきます。
抗がん剤(タキソテール)の開始時期についても意見が割れるところですが、フローチャート(1)が参考になると思われます。
★ フローチャート(1)
★ フローチャート(2) ・・・ 国内で比較的多い例を示す
【MAB】 |
【単剤】 |
1(b)・LH-RHアナログ剤 + 抗男性ホルモン薬
(リュープリン or ゾラデックス) + カソデックス
↓ |
1(a)・LH-RHアナログ剤
リュープリン or ゾラデックス
↓ |
2(b)・カソデックス(or両方共)中止
(抗アンドロゲン除去症候群の確認)
↓ |
2(a)・非ステロイド系抗男性ホルモン剤
カソデックス(非ステロイド系)
↓ |
↓ ← ← ← ← ← ← ← ← ← ← ← ← ← ← |
3・別種抗男性ホルモン剤: オダイン(非ステロイド系)→プロスタール(ステロイド系)
↓ |
4・女性ホルモン系低容量抗がん剤: エストラサイト or プロセキソール
↓ |
5・ステロイド剤: デカドロン、プレドニン など
↓ |
6・抗がん剤 : タキソテール+ステロイド剤 (or タキソテール単独)
(上記の各段階で治療効果がなくなれば、中間段階を飛ばして「6」に移行する) |
- 抗男性ホルモン剤には非ステロイド系(カソデックス、オダイン)とステロイド系(プロスタール)がある。
ステロイド系の効果は非ステロイド系より弱い。
- 同じステロイド系の比較ではカソデックスのほうがプロスタールより肝機能への影響が小さい。
- 女性ホルモン剤のホンバンは製造中止となり、代用としてプロセキソール等が用いられている。
- エストラサイトは血栓に注意(肺塞栓・脳梗塞・脳血栓・心筋梗塞等の危険性)
抗男性ホルモン剤は効果がなくなっても一旦中止後再使用すれば再度効果が復活することもある。
● 今後期待される薬
(注)第Ⅲ相臨床試験に至らないものは省略しました。(順不同)
これらの恩恵に浴するのは、まだ当分先の話と思ってください。
慌てて医師と相談しても、医師もご存じないケースも、珍しくありません。
現在国内でこれらの薬剤を用いた治療(or治験)を受けることは困難だと思われます。
・プロベンジ
ホルモン不応性前立腺がん患者を対象とした第Ⅲ相臨床試験で全生存期間の延長が判明。
2010年に米国FDAにより承認。世界的にも注目をあびている免疫系がん治療ワクチン。
・ブロプレス:アンジオテンシンⅡ受容体遮断薬(ARB)
ARBは本来は降圧剤ですが、進行前立腺がんにも一定の効果がある。(標準治療ではありません)
・ケトコナゾール(Nizoral:適応外薬)、アミノグルテチミド(未承認薬)
副腎における男性ホルモンの分泌を抑制する。欧米ではすでに用いられています。
・ニルタミド(Nilandron)
抗男性ホルモン剤(非ステロイド系:国内未承認)
特に新しい薬でもなく、欧米では普通に使われているが、日本では使えない。
・カバジタキセル(Jevtana)
タキソテールも効かなくなった前立腺がんに対して用いられる新しいタキサン系抗癌剤。
2010年、米国FDA(食品医薬品局)はプレドニゾンとの併用で承認。
・アビラテロン
男性ホルモンの合成に関与する酵素「CYP17」を選択的に阻害し、精巣や副腎でのテストステロンの
産生を抑える薬剤で、第Ⅲ相臨床試験で全生存期間の3.9ヵ月延長(プレドニゾン併用)が認められた。
米国FDA(食品医薬品局)は2011年4月28日、アビラテロン(製品名「Zytiga」)を承認した。
ホルモン療法抵抗性の転移性前立腺癌で、タキソテールベースの化学療法が無効となった患者が対象。
低用量のステロイドと併用される。
・デガレリクス
2008年末にFDAが承認し、欧米ではすでに用いられている。
リュープリン、ゾラデックスはLH-RHアナログ(類似薬)ですが、これはLH-RHアンタゴニスト(阻害薬)。
フレアアップ現象を来さないのが利点。
・MDV3100
MDV3100は第二世代の経口抗アンドロゲン剤
カソデックスよりも優れた抑制作用を示し、カソデックス抵抗性癌にも効果が見られる。
現在、ドセタキセル(タキソテール)の治療歴を有するホルモン非感受性前立腺癌患者を対象とした、
国際第Ⅲ相臨床試験が行われている。
・TAK-700
非ステロイド系の男性ホルモン合成酵素阻害薬。酵素(17,20-リアーゼ)の働きを阻害し、精巣・副腎の
男性ホルモンを抑制する。
進行性前立腺癌患者を対象として、全生存期間と無増悪生存期間を評価する国際第Ⅲ相臨床試験が
2010年11月より始まっている。日本も米国よりは遅れるがこの国際試験に参加する予定。
■ 骨転移
骨転移しやすいがんの両横綱は前立腺がんと乳がん。以下、肺がん、甲状腺がん、腎臓がん、子宮がんと言ったところでしょうか。
前立腺がんは重度に進行すると骨転移が生じやすく、骨転移は進行と共に痛みを伴い、骨損傷のリスクを増大させます。
血液中に多量のカルシウムが溶け出す「高カルシウム血症」と呼ばれる状態になると、生命に危険が及ぶ場合もあります。
こうした骨転移症状の治療には、以下の様々な対応が考えられます。
● 緩和ケア(疼痛ケア・精神的ケア)
”がんになったら緩和ケア” ”いつでも、どこでも緩和ケア” という緩和ケアを認知、普及させる運動が、近年始まっています。
身体的苦痛のケアが中心になりがちですが、本来、緩和ケアとは疼痛管理に限らず、体と心の苦痛を和らげる全人的ケアのことで、
がん治療の初期からのあらゆる過程で考慮されるべきものなのです。
重度な排尿困難には、経尿道的前立腺切除術(TURP)が有効です。
現実に痛みが生じている場合には、なにをさておき、疼痛の緩和を医師に訴えてみましょう。
患者自身の痛みからの解放は、がん対策基本法でも重要項目として取り上げられた緩和医療の精神であり、訴えることになんら遠慮は要りません。
「WHO方式3段階除痛ラダー」に添った正しい緩和療法を受ければ、がん患者のほとんどは(90%近く)痛みから解放されることが可能ですが、
日本ではこれまで、緩和ケア=終末期医療、モルヒネ(オピオイド)=最後の手段、という誤った認識が、一般社会のみならず、
医師の間にも普及してしまっており、モルヒネ使用に消極的な医師がまだまだ多いようで、
2006年の日本ペインクリニック学会の調査によれば、緩和療法とは何かを正しく把握している医師は半数にも満たないそうです。
G7(先進主要7カ国)におけるモルヒネ消費量は日本が最下位、アメリカの1/20、カナダの1/12、ドイツの1/7 にしか過ぎません。
緩和ケアについてのより詳しい解説は下記のリンク先をごらんください。
オピオイドが効きにくい痛みとして代表的なのは「骨転移痛」と「神経因性疼痛」です。
がん細胞が骨に転移し、分裂増殖を始めるのは、骨の中央部の海面質からですが、こうした初期の骨転移なら、オピオイドも効きやすいのですが、
外周の皮質骨(緻密質)が圧迫骨折を引き起こし、神経を損傷しているような進行型の骨転移では、その痛みも耐え難く、
運動機能も喪失し、オピオイドによる疼痛緩和も困難です。
こうした難治性の痛みに対して、試みる価値があるのは、痛みを伝達する神経線維に注射を打つ神経ブロック療法か
皮下埋込型ポートを使って行うクモ膜下オピオイド投与です。
クモ膜下オピオイド投与を行うと、多量のオピオイドによる傾眠傾向が患者のQOLを大きく下げてしまっている場合などには、
寝たきりだった患者が普通の生活ができるほど劇的に効くケースもあるとのこと。
ただし、疼痛緩和がうまく行ったとしても、それだけでは骨転移の進展を食い止めることはできませんので、
骨転移の場合の緩和療法は、以下の処置法と組み合わせて用いるのが一般的です。
● ゾメタ(ゾレドロン酸:ビスフォスフォネート)
骨転移、骨塩量の維持(ホルモン療法を継続すると骨塩量が低下しやすい)にはビスフォスフォネート剤
(ゾレドロン酸「ゾメタ」が用いられることが多い)の早期使用が望まれます。
骨には骨を壊す破骨細胞と骨を作る骨芽細胞という2種類の細胞があり、骨はそれらによって常に作り変えられています。
がん細胞は破骨細胞の力を借りて骨に転移します。
骨に転移したがん細胞には「溶骨型」と「造骨型」があるのですが、前立腺がんの場合は「造骨型」が多いと言われています。
骨転移そのものが直接生命に危険を及ぼすことはありませんが、痛み、病的骨折、しびれ、麻痺、喉の渇き、悪心、嘔吐などの
さまざまな骨関連事象が現れます。
ビスフォスフォネートは、骨密度の低下を防ぐことができ、骨破砕の危険を減らすと共に、痛みを減少させます。
作用機序(プロセス)は完全には解明されていませんが、破骨細胞の活動を押さえ、
アポトーシス(細胞死)を引き起こすことにより、骨塩量の減少を食い止めると考えられています。
がん細胞は、破骨細胞を活性化させ、骨の破砕を引き起こす様々な要因を引き起こしますが、ビスフォスフォネートは、
破骨細胞の活動を抑えることによって、がん細胞の骨密度に及ぼす悪影響を小さくし、骨病変を緩和し、高カルシウム血症を改善させます。
骨転移や骨密度低下の治療薬としてFDAに承認されているビスフォスフォネートには、第2世代薬アレディア(パミドロン酸)と、
より新しい第3世代薬ゾメタ(ゾレドロン酸)があります。これらの2つの薬ではゾメタの方により多くの利点があります。
ゾメタが特に優れているのは、アレディアと同等の効果を得るのに1/10未満の服用量で良いという点です。
これまで数時間かけて摂取していたものが15分程度で済むようになったことは、この薬を利用する患者にとっては画期的なことと言えるでしょう。
ただ、長期に用いる場合には、腎障害と顎骨壊死に注意が必要です。
ゾメタは骨転移を伴う前立腺がん患者に対し、有用性が高い薬です。(副作用も許容範囲)
ホルモン療法の長期継続は骨塩量の減少を引き起こすので、こうした患者にも有用な薬といえるでしょう。
北海道大学発表の多施設間共同ランダム化試験によると、骨関連事象の抑制効果、疼痛の抑制効果に加え、
内分泌不応性前立腺がん患者(n=71名)の生存期間を有意に延長することが判明した。
ゾメタ投与群:非投与群=25.2ヵ月:17.1ヵ月。・・・Urology View Vol.7 2009
骨転移の広がりが6ヵ所以上で、ホルモン療法未治療の臨床病期D2の前立腺癌患者28人を対象とした多施設共同臨床試験で、
ホルモン療法にゾレドロン酸(ゾメタ)を併用することでPSA値が顕著に低下し、再燃までの期間を延長する可能性が示された。
・・・2010年第98回日本泌尿器科学会総会 横浜市大他。
・参考:2006年の第2回がん患者大集会の折にもらったチラシ → 「骨転移難民の方々への朗報」
・今後期待される骨転移の薬・・・■デノスマブ(denosumab)
第3相臨床試験の結果によると、デノスマブ(AMG162:ヒトモノクローナル抗体)は、前立腺がんを含む
固形腫瘍の骨転移に対して、骨関連事象(合併症)の出現を遅らせる効果はゾメタ(ゾレドロン酸)より
優れていると言う。愕骨壊死などの副作用の頻度はゾメタと変わらない。
FDAがホルモン療法を受ける前立腺がん患者の骨量減少予防の適応拡大申請を承認した。
● 放射線治療(緩和照射)
【外部照射】
骨転移の痛みを取る方法として最も広く行われているのは、放射線の外部照射です。
完治を狙う放射線療法に対し、とりあえず痛みを取るという意味で「姑息照射」とか「緩和照射」と呼ばれています。
麻痺が出てからでは、放射線をあててもなかなか症状が改善しません。しびれ以前の早い段階での放射線治療が望まれます。
骨の痛みを取るための放射線の照射方法と放射線治療の副作用は、照射部位によって異なります。
やや低めの線量を広範囲に当てることが多いため、通常は高精度照射の必要はありません。
- 激しい骨痛はオピオイド(医療用モルヒネ)が効かない場合も多い。
- 骨転移の疼痛除去に用いる緩和照射は、数回に分けて行う方法もあるが8gyの1回照射でも有効かつ安全と認められた。
- 頸椎や胸椎などの主要支持部に対し、骨転移の危険性を回避するため、予防的放射線照射を行うことがある。
【体内照射:放射性アイソトープ(Sr-89)】
「体内照射」というのは小線源療法の「内部照射」「組織内照射」とは大きく概念が異なります。
少量の放射線を帯びた、ストロンチウム-89のような放射性アイソトープを静脈に注射すると、血流に乗って全身に運ばれ、
それが前立腺がん細胞に犯された骨格部位に蓄積し、放射線(ベータ線)を発します。
これによりストロンチウム-89で治療された大多数の患者で、骨転移の痛みとそれに伴う鎮痛剤の使用量が軽減されます。
外部照射の効果は身体の特定のエリアに限られるのに対し、ストロンチウム-89を用いるならば、骨格全体に影響を与えることができます。
ただし、ストロンチウム-89の主たる副作用である血小板、白血球および赤血球の減少に注意を払う必要があります。
放射性同位元素(Sr-89)を用いた静注とは「メタストロン注」のことで、欧米ではすでに放射線内用療法剤として、
前立腺がんや乳がんなどの骨転移による疼痛緩和に広く用いられています。現在、世界42カ国で承認・使用されており、侵襲性が少ないこと、
骨転移腫瘍患者の疼痛緩和に有用性が高いことなどが高く評価されています。日本では2007年に承認されました。
微弱とはいえ放射性物質ですし1本が30万円ほどする薬ですから、決してお手軽とは言えませんが、
多発骨転移でペインコントロールに悩んでおられる方にはその選択肢が増えました。
使用例がまだ多くはないのですが、効果は1~2週間で発現し、3ヶ月ほど持続するとか。
ストロンチウム-89の使用に際しては現実的な問題点もあるようです。
ストロンチウム-89の内用療法は「ベーター線放出核種放射線治療」の一種であるため、
放射線取扱上の安全管理の知識と管理体制が必要であり、ベータ線測定器や薬剤の分注器などの設備投資や備品購入などが必要とされるものの、
現在はこれらの諸費用はすべて医療施設側の負担となっており、
これが普及を遅らせている大きな要因となっているとのこと。
2008年9月現在、その医療行政的配慮を求める署名活動が行われています。
・今後期待される体内照射の薬・・・■アルファラディン(Alpharadin)
メタストロン注はベータ線(ストロンチウム-89)を放出する薬ですが、アルファラディン(Alpharadin)は
アルファ線(ラジウム223)を放出する放射性同位元素。メタストロン注と同様、体内照射に用いられる。
アルファ線(ラジウム223)はベータ線(ストロンチウム-89)に比べて放射線量が数倍大きく、
逆に飛距離と崩壊時間の短いのが特徴。現在、国際共同第Ⅲ相臨床試験が行われている。
● 骨セメント療法
骨セメント療法という身体的負担が小さく、患者に優しい治療法があります。
複数ある骨転移巣にも対応でき、CTで位置を確認しながら少し太めの注射針を刺し
1~2ccの骨セメント(ポリメチルメタクリレート)を注入し、半日安静に横たわるだけ。
これだけで、ほぼ9割の人が骨痛緩和の恩恵を受け、2割の人の骨痛が完全に消えると言う。脆くなった骨の補強にもなる。
まれに、セメント材料が漏れ神経等を圧迫したり、血管に入って血栓を作り、肺塞栓を起こした例も報告されているので、やはり経験豊富な医師が望ましいでしょう。
たとえ予後の少ない患者であっても、日常生活動作が不自由なく行えるようになることは、大きな喜びに違いありません。
骨セメント療法を導入している医療機関をリストアップしておきますが、内容は未確認ですので、問合せの際には十分ご注意ください。
・旭川厚生病院 ・岩手県立北上病院 ・岩手医科大学病院 ・福島県立医大病院(麻酔科)
・茨城県立中央病院 ・茨木県立中央病院 ・栃木県立がんセンター ・群馬大学病院 ・聖路加国際病院
・東京大学付属病院 ・聖マリアンナ医科大学病院 ・信州大学病院 ・金沢大学病院 ・愛知県がんセンター
・滋賀医科大学病院 ・京都第一赤十字病院 ・大阪市立大学病院 ・関西医大付属滝井病院
・兵庫県立成人病センター ・岡山大学病院 ・中国労災病院 ・広島大学病院 ・高知大学付属病院
・久留米大学病院 ・福岡大学病院(特記なきものはすべて放射線科)
● 整形外科的手術療法
骨折が生じたり、脊髄圧迫による麻痺、あるいは他の治療法でどうしても痛みが取れないとき等は、整形外科的手法に頼らざるを得ません。
かつては患者の身体的負担が大きいため、なかなか踏み切れなかった治療法ですが、最近は生体になじみやすい人工部材が開発されると共に、
手術方法の洗練化も相まって、こうした手術も患者に身近なものとなってきました。
骨転移巣の腫瘍を切除撤去後、人工骨や人工関節、人工椎体、髄内釘(ずいないてい)等に置き換えるのが一般的な手術法で、
モルヒネや放射線で取りきれない体動時の痛みからも解放され、運動機能の回復も見込めることから、患者のQOLへの寄与は大きい。
特に前立腺がんの場合は、骨転移を生じても長く生きる患者が増えており、骨痛の除去に留まらず運動機能も含め、いかに不自由なく
高いQOLを保って生活を送れるかが関心事となってきており、こうした整形手術への期待も高まってきている。
脊椎に転移したがんは、少しでも脊髄を損傷させると重大な麻痺や後遺症が残るため、脊椎の背中側から行うこれまでの手術法では
治療が難しいとされてきたが、脊椎の内側から細いワイヤーソー(糸鋸)を通し、転移巣を大胆かつ安全に切除し、
摘出跡周辺を抗がん剤で洗浄後、人工椎体もしくは自家骨を用いて脊椎を再建する
”腫瘍脊椎骨全摘術”という手法があります。
ワイヤーソーを用いた脊椎骨全摘術が受けられる医療機関はいくつかあるが、高度先進医療として認定されているのは金沢大学付属病院のみ。
・金沢大学付属病院 ・北海道大学病院 ・秋田大学附属病院 ・慶應大学病院 ・濁協医科大学病院(いずれも整形外科)
|