|
1・検診から病状を知るまで
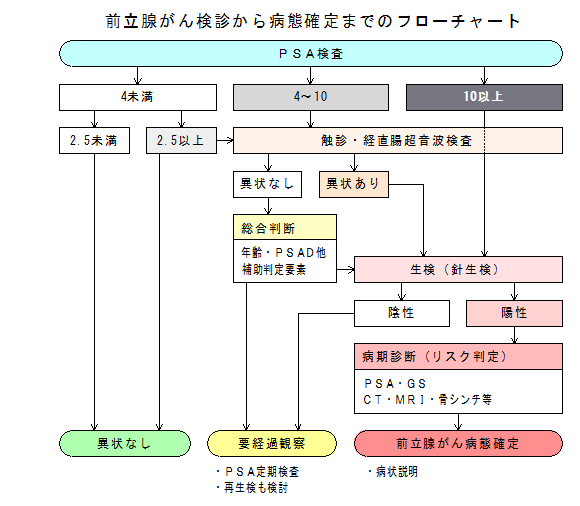
前立腺がんの診断においては、がんを見落としてもいけないが、だからと言ってグレーゾーンのすべてに生検(針生検とも言う)を実施するというのも、ちと乱暴な話です。
直腸指診、超音波(エコー)、年齢、血縁者の前立腺がん病歴に、下記の補助的判定要素を加味して、総合的な判断を下して欲しいものです。
グレーゾーンでも下の方(4とか5ぐらい)で「生検が必要」と言われたら、医師に判断の根拠を尋ねてみてはいかがでしょう。
若い人の場合、PSAの閾値が4.0では高すぎる、もっと引き下げるべきだという主張があります。検査機関によっては3.5としているところもあるし、
年齢に応じて、順次値を下げているところもあります。
海外では40歳台の人に対しては、閾値を2.5まで下げるケースも珍しくないようですが、画一的な運用では、不必要な生検の増加とそれに伴う過剰治療が懸念されます。
要は、医師がどれだけ丁寧に補助的判定要素を検討し、総合的な判断を下すかに掛かっています。
■補助的判定要素
PSAD(PSA密度orPSAデンシティ)
PSAの値を前立腺の体積で割った値、大きいほどがんの可能性大。(0.15以上:要注意)
F/T比(遊離PSA比率 = 遊離PSA/総PSA = フリーPSA/トータルPSA)
低いほどがんの可能性大。(15%以下:要注意、7%以下:がんの可能性)
PSA速度
過去のデータより、PSA上昇の速度をチェックする。早いほど要注意。
2・PSA: がんの活性度を示す。
PSAとは前立腺で作られる糖タンパク質で、がんがあると血液中に漏出するPSAの量が急激に増加するため
前立腺がんの判定指標として広く用いられています。
「前立腺(注:「前立腺がん」ではない)特異抗原」と称される通り、
がん以外の炎症や肥大にも一定の反応を示します。 単位はng/ml(ナノグラム/ミリリットル)
PSAは内分泌薬でコントロールが効く場合がほとんどです。(ただし長期にわたると耐性が生じてきます)
「4以下:ほぼ安全、4~10:グレーゾーン、10以上:がん濃厚」と良く言われますが、さほど合理性はありません。
若い人(50歳未満)の場合、グレーゾーンの下限値を2.5に引き下げるべき、という提案も一部でなされています。
グレーゾーンなら「針生検」となることが多いのですが、がん陽性率は3割以下、たとえがんでもおとなしいケースが
多い。ならばあわてて針生検を受けないで、「経過観察」(一定期間ごとにPSA検査)とするのも一つの選択肢です。
前立腺がんならPSAはその後もじわじわ上昇することが多いのですが、体質的なもの、前立腺肥大による場合はほぼ一定値を保ちます。
PSAの値が3桁(数百)の人、4桁(数千)の人も居られます。たとえあなたの数値が高かろうと動揺することなく対処法を考えましょう。
前立腺がんは「腺がん」が9割以上を占めますが、まれに「小細胞がん」等でPSAが上昇しにくいタイプのがんも
あります。(数%) PSA値が低いだけで安全、もしくはおとなしいがんと言い切れるものではありません。
PSA値は上昇時、常態時とも個人差が大きく、PSAの数値だけから病期を予測することは困難です。
下表はPSA値の意味を一目で判りやすくまとめた表です。がん陽性率も資料によって
その数値が異なります。診療の指標として一般的に利用されているグレーゾーン(4~10)の考え方自体、その根拠は
希薄です。PSA値とがん陽性率は全体的に右肩上がりの相関関係を示すだけで、4や10等特定のポイントで陽性率
が急に変化するわけではありませんので「閾値」に厳密な意味はありません。PSAとはそもそもこうした大雑把な傾向を示すものと理解し柔軟に受け止める必要があるでしょう。
<表:PSA値>

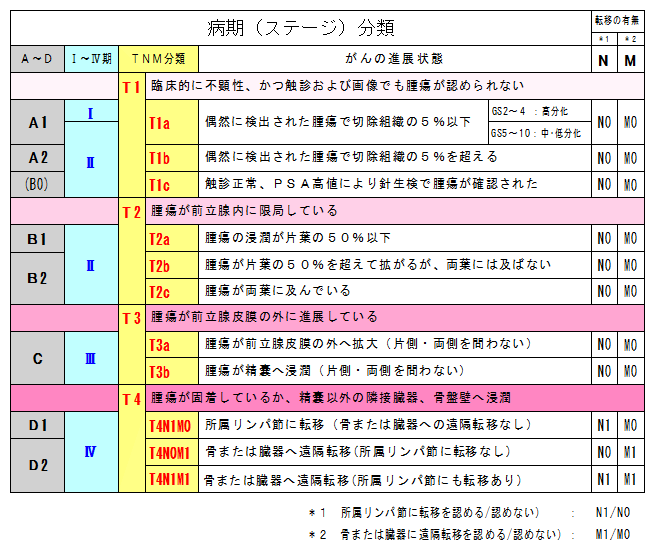
3・病期(ステージ): がんの進展の度合いを示す。
日本ではこれまで、患者への病状説明は泌尿器学会が定めた”ABCD分類”を用いることが多かったのですが、近年は
世界共通で臨床状況をより正確に伝えられる”TNM分類”が使われることが増えてきました。
本稿でも2005年に初めてアップした当時は”ABCD分類”を用いていましたが、2008年2月より”TNM分類”を標準表記とし内容を書き換えました。
TNM分類でのT1cは、従来の診断法ではがんの存在を指摘できない場合でも、PSAの普及に伴いPSA高値により見つかることが多くなり、
1992年のUICC分類改定時に付け加えられた。T1グループとは言うものの、臨床的に注意を要する病期未定状態であるため、
”ABCD分類”では病期Aに含まず、病期B0と表現されることが多いです。
もしもこうした判定を受けたなら、実際のがんの進展度を詳しく問いただしたほうがよいでしょう。
”ABCD分類”での病状説明は下の表にてTNM分類に置き換えが可能です。
たとえば、病期(ステージ)B1と告げられた場合、TNM分類ではT2a,N0,M0となります。
我国のTNM分類は、新しい(2002年版)UICC(国際対癌連合)分類と、古い(1997年版)UICC分類に準じる「前立腺癌取扱い規約(第3版3)」の
2種類がまかり通っており、実に複雑怪奇な様相を呈しています。
我国の前立腺がんの解説書の多くは、2002年版UICC分類を採用し、T2の亜分類を、T2a、T2b、T2c の3種類としている一方、
公的ながん情報サイト「がん情報サービス」の分類は「前立腺癌取扱い規約(第3版3)」に倣い、T2の亜分類は、
T2a(片葉に及ぶ),T2b(両葉に及ぶ)の2種類となっています。
NCCN(National Cancer Comprehension Network)では、病期(ステージ)T2b以上をハイリスク状態と規定していますが、
これは新しい(2002年版)UICC分類ゆえ、がんが「前立腺の片葉の過半に及ぶ」状態のことを差すですが、
「がん情報サービス」では、T2bはがんが「両葉に及ぶ」という意味になってしまいます。
どうしてこんなややこしいことになっているんでしょう!
こうした食い違いは患者にとってははなはだ迷惑であり、患者のみならず医療者間でも誤解が生じかねないのではないでしょうか。
病期分類(UICC 2002年版)
4・グリソンスコア(GS): がんの性質の良し悪しを示す。

前立腺がんの病巣は一塊ではなく分散していることが多い。またその細胞の種類も均一ではなく、
悪性度の異なる複数の細胞が混在しているのが普通です。
こうした前立腺がんの性質を臨床上簡便に把握する方法として、グリーソン(Gleason:米国)によって考案されたのがグリソンスコア(GS)。
顕微鏡下で細胞の顔つき(構造異型)を判断し、悪性度(1~5)を判断している。異型細胞の占める割合の最も多いものの評価をプライマリースコア
(優勢型)、次に多いものの評価をセカンダリースコア(従属型)と称し、その両者の和をグリソンスコアすなわちGS(2~10)と称している。
プライマリースコアとセカンダリースコアをそのまま並べて「4+3」のように表すこともあれば、単にその和「7」と表記することもある。
したがって、同じ「7」でも厳密に言えば「3+4」と「4+3」は意味が異なるわけで、もちろんプライマリースコアの数値が大きい後者の方が悪性度はやや高くなる。
注:GS=7(4+3)に関しては下記の区分(中分化がん)によらずを低分化がんとして扱う例もあります。
・高分化がん:GS= 2~4 (軽度異型性) |
… すなおな良い子(放っておいてもほぼ大丈夫) |
・中分化がん:GS= 5~7 (中度異型性) |
… 普通の子 |
・低分化がん:GS= 8~10 (高度異型性) |
… 性質の悪い子(生育が早く再発・転移しやすい) |
良い子・悪い子・普通の子の判断は、異型細胞同士を比較した場合の話で、正常細胞から見れば、皆、多かれ少なかれグレていることには違いありません。
高分化がんは異型細胞のなかでもかなり正常細胞に近い顔つきのもので悪性度は低いのですが、
低分化がんは成長が遅いと言われている前立腺がんの中でも比較的成長が早く進展しやすい、
また、予期せぬ被膜外浸潤・リンパ節転移・微小遠隔転移等が潜んでいる確率が高く予後の成績(再発等)も思わしくないと言われています。
分化度の判定(GS)はプレパラートの顕微鏡視野、観察者主観によるので絶対的な物差しは存在しません。
また、判定者が必ずしも”病理専門医”と限らないのが実情のようで(病理専門医も圧倒的に不足しています)
このあたりがセカンドオピニオンで「プレパラート持参」を要求されるゆえんです。
40前後と言えば前立腺がんの罹患者としては若い方ですが、こうした人で(もちろん若い人ばかりとは限りませんが)、
PSAが低いにもかかわらず早々と転移してしまったケースを耳にすることがありますが、
始めから”ホルモン不応性”の低分化がんである可能性が疑われます。
前立腺がんは臨床学的分類では「腺がん」がほとんどですが、こうした場合、
割合としては少ないものの非腺がん(小細胞がん等)である可能性があります。
”ホルモン感受性”の前立腺がんも、ホルモン療法を続ければやがて耐性が生じ”ホルモン不応性”へと変わります。
前立腺がんにはしばしば進行が遅いケースもありますが、こうなると進行速度も早くなるケースが多く、もはや油断がなりません。
抗がん剤も視野に入れつつ薬物療法の次の手を模索しなければならない難しいケースとなってしまいますが、
「QOLを保ちつつがんと共存する」手はいくつかあります。ともかく簡単に諦めてはいけません。
詳しくは”§3・転移がん・再発(再燃)がん”を参照してください。
*病期とGSによる生命危険度・・・厚生労働省研究班
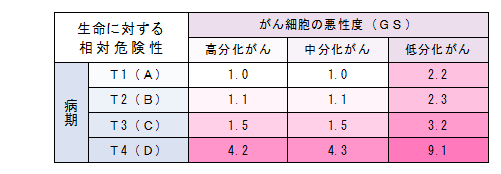
すなわち、病期(がんの進行度)だけで危険性の判断はできない、がんの性質(GS)の見極めも非常に重要ということですが、
残念ながら、いまだ病期ごとの治療法しか解説していない医療機関のHPが圧倒的多数を占めています。
GSのいかんにかかわらず常に他の病期より危険性が高いといえるのは、転移がん(N1、M1)の場合だけです。
がんとの対峙方法には根治を目指して向き合う方法と、がんをうまくだまして共存させる方法があります。
転移がん・再発がんにおいては今の医療技術では根治は難しく、通常後者の方法を選択します。
次項「リスク群」ではT3までのリスク分類について解説し、がんとの共存を目指す転移がんと再発がんは
それぞれの対処法が類似していることもあり、別項(§3)で扱わせてもらいました。
病状は病期・PSA・GSの三つを総合的に判断すべき
で、病期のみで症状を理解しょうとするのは片手落ちです。
上表(前項)は病期とGS、二つの要素からリスク分析を行ったものですが、米国にはこれにPSAを加えた三つの要素で
大規模な統計に基づく詳細なリスク分析資料があり、パーティン・ノモグラムと呼ばれています。
これらの具体的な説明に入る前に、病期・PSA・GSの概念をご理解いただきたいので、多少強引ですが、
ドライブ用語にたとえて話をしてしまいましょう。
病期=走行距離・・・進んだ軌跡、進展の度合い。進みすぎるとスタート地点に戻るのが厄介。 PSA=スピードまたはエンジンの回転数・・・活性度(暴れ具合)です。 GS(グリソンスコア)=ドライバーの性格・・・人もがんも性格はさまざま。
どんなドライバーが【GS】、どんな勢いで【PSA】、どこまで走ってきたか【病期】!
これが病状を知る3つのポイントです。
内分泌薬で走行スピード(PSA)は大抵簡単に落とせますが、ドライバーの性格(GS)までは変えることができません。
とんでもない道へどれだけ進んできてしまったか(病期)は、再び正しい道へ戻ることができるかどうか(治癒しうるかどうか)の判断に大いに参考となりますが、
予後の良し悪しは、むしろ車のスピード(PSA)と、ドライバーの性格(GS)に関係が深いことが知られています。
前立腺がんの特徴を示すこれら3つの要素には、それぞれに内在する「固有リスク」があり、これらの組み合わせにより「トータルリスク」が決まるわけです。
わが国ではこれまで、治療法の決定にあたっては病期のみを重視する傾向が強かったわけですが、PSAやGSも病期と同様患者の予後に深くかかわっており、
「治療法の選択もトータルリスクに基ずいて行うべき」という考え方が、2002年頃から欧米を中心に広がってきました。
NCCN(National Comprehensive Cancer Network)のガイドラインがこの考え方を主導しています。
生検や画像診断で判明した病期のことを臨床病期と言いますが、手術によって採取された組織を顕微鏡で調べた場合(病理病期)は必ずしも
これと同じ結果が出るとは限りません。実際には病期T1,T2といえども術後病理検査で浸潤(T3)やリンパ節転移(N1)が
発見されることも珍しくありません。
「固有リスク」が高いことと、臨床上隠れている浸潤やリンパ節転移が見つかる確率には、明白な相関関係が見られます。
米国では大規模な統計によって、こうした浸潤やリンパ節転移が隠れている確率を突き止め、パーティンノモグラム
(より詳しい解説はこちら)と呼ばれる表が作られています。
治療法の選択に当たり、病期を主体とした解説を読む場合には、同じ病期であっても、PSA、 GSの双方が高リスクならば、
概ね一段上の病期と同様に考えるぐらいの慎重さがあってしかるべきでしょう。
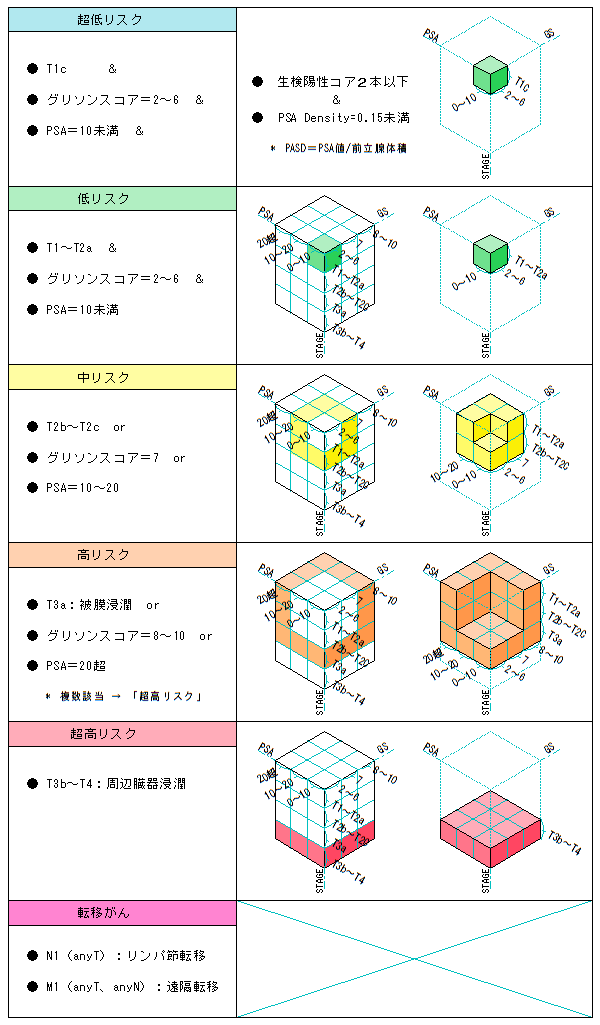
■
固有リスク
要素 | 低リスク | 中リスク | 高リスク |
病期 | T1a~c、T2a | T2b、T2c | T3a~b |
PSA | 10未満 | 10~20未満 | 20以上 |
GS | 6以下 | 7 | 8以上 |
■
トータルリスク
<トータルリスク> <固有リスクの組み合わせ>
(超)低リスク ・・・ 固有リスクのすべてが「低」である場合
高リスク ・・・ 固有リスクの少なくとも一つが「高」である場合
超高リスク ・・・ T3b~T4の全て、及び、複数の固有リスクが「高」である場合
中リスク ・・・ 上記以外のすべて
* 解説図
6・「リスク分類」の説明と主な標準治療法
まずはじめに、各リスク群ごとの10年PSA非再発率を記しておきます。
( 出典は
「放射線治療計画ガイドライン・2008・前立腺がん~外部照射~」 )
(超)低リスク群 80% 中リスク群 50% (超)高リスク群 30%
手術・放射線治療(70gy以上)とも10年PSA非再発率に変わりはありません。
■
超低リスク群・低リスク群
現在の医療水準では「低リスク群」なら治って当たり前。がんだと言っても少しも驚く必要はありません。
実は、低リスク群では積極的な治療を必要としないがんもめずらしくなのです。
鋭敏なPSAマーカーが用いられるようになってから、初期で発見される前立腺がんが増えるのに伴い、
前立腺がんの生存率も良くなって来ているのですが、他方、健康上何の影響も及ぼさない「ラテント癌」
の発見も多くなります。
非前立腺がん患者(50歳以上)の死後解剖(剖検)によれば、ほぼ1/3から前立腺がんが見つかるそうです。
がんの存在を告げられて動揺する人も居れば、知らないまま一生を終えてしまう幸せな方もめずらしくないわけで、
病理的には存在が確認されるものの、健康上何の実害もないラテント癌に対して行われる
無意味な手術は、近年手術全体の約2割を占めると言われています。
手術をすれば、たいてい何らかの副作用が残りQOLの悪化を招くわけですから、こうした過剰治療は、患者にとってはやはり迷惑この上もありません。
「低リスクがんならば、10年生存率は治療を行っても行わなくても変わらない」という米国のデータが存在します。
高齢者(米国では余命10年=70歳と考えるが、日本人男性の余命は少し長く75歳と考えることが多い)なら、この程度の
前立腺がんならば、無治療のまま忘れ去ってしまっても良いと言うのです。
PSA検査によって発見されたがんが「低リスク群」に属する場合は、臨床的にはあまり意味の無い「ラテントがん」である可能性も十分あるわけで、
落ち着いて"監視療法(経過観察)"という道を探ってみるのも、良い判断と言えるでしょう。
監視療法中にPSAが上昇してもまだ打つ手が沢山あるわけで、それで手遅れになることはまずありません。
NCCNの2010年のガイドラインでは、低リスク群の中でも、とりわけリスクが低いと思われるものを、「超低リスク群」(very low lisk)と分類し、
これに該当するものには、監視療法をファーストラインとして強く勧める方針を打ち出しました。
生検コアサンプルの陽性が3本以下(かつ生検本数の50%以下)、かつ、PSAデンシティ(PSA値をPSA体積で割ったもの)が0.15以下というのが、
新たに付加された「超低リスク群」の条件です。
<主な標準治療>
【超低リスク群】
・監視療法(期待余命が20年未満なら)
・低リスク群に準じる(期待余命が20年以上なら)
【低リスク群】
・監視療法(期待余命が10年未満なら)
・小線源療法
・放射線外部照射
・前立腺摘除術±リンパ節郭清
■
中リスク群
基本的には「中リスク群」もさほど恐れる必要はありません。ほとんど完治します。
治療法には多くの選択肢があり、どの治療法にも必ず一長一短があります。
医師まかせでもおそらく命だけはなんとかなる、というのがこの「中リスク群」でもあるのですが、
うっかり思わぬ後遺症(副作用)を背負ってしまう恐れもなきにしもあらずです。
がんと告げられた驚きとあせりから、とかく「命さえ助かれば」という短絡的思考に陥りがちですが、
大切なのはまずはあわてないこと。冷静に、完治を信じ、予後の生活のQOLをじっくりと考えて、
自らの意思で治療法を選択してください。これが出来るのは医師ではありません、ほかならぬあなた自身です。
もしもあなたが精神的に追い詰められているとしても・・・私もそうでしたからやむを得ませんが・・・
今しばらくじっと堪えてみてください。
だいじょうぶ、精神的に苦しいのはほんの数ヶ月、
それに引き換え予後の副作用に悩むのはもっとはるかに長い年月です。
国立がんセンターの鳶巣総合病棟部長(当時、現:静岡がんセンター病院長)は「がんについての市民公開講演会」の最後にこうおっしゃっています。
(注:以前は国立がんセンターのHPで全文が読めたのですが、現在は残念ながらリンク先が消滅。)
「がんの治療法を選択することは、自分の生き方を選ぶことになる場合が多い」
まったく同感です。家を選ぶのに他人任せにする人は少ないでしょう、ましてや治療法の選択は
今後の自分の生き方に、場合によっては生きるか死ぬかにも、そのまま直結するわけですから。
「中リスク群」においては、本来は精神的にもっと余裕があっても不思議ではないのです。
治療を開始するまでの時間もあなたが思う以上にもっと余裕があるのです。
できるだけ落ち着いてご自分にとって最も良いと思われる治療法をじっくり選んでみてください。
きっと来年の今頃は現在の心痛がうそのように思えてくることでしょう。
<主な標準治療>
【中リスク群】
・監視療法(期待余命10年未満なら)
・放射線外部照射±短期ホルモン療法±小線源療法
・前立腺摘除術±リンパ節郭清
■
高リスク群
病期がT1、T2で内在リスクが大きい場合(PSA又はGSがハイリスク状態にある)、あるいは病期がT3aで内在リスクが小さい場合は
「高リスク群」に分類されます。これでもまだまだ完治が望めます。
ただ、注意しなければならないのは、臨床診断時に告げられた病期が、手術時の病理検査で浸潤・転移が新たに発見され、変更される場合も
少なくないということです。
臨床病期がT2であっても浸潤が見つかれば、T3に訂正されます。この時、
手術だけでは再発する可能性が多いと判断された場合には、放射線療法との併用という判断に切り替わることもあります。
全摘の後PSAが下がりきらない場合には、ホルモン療法に頼るか、放射線外部照射を追加すべきかの判断が迫られます。
また、全摘に先立つリンパ節郭清時に、リンパ節への転移が判明(N1)し、
全摘が中止される場合もありますが、これは決して医師から見捨てられたわけではありません。
より良い結果を求めるために、あえてそうするのですから、これも治療法の一つと考えてください。
このように臨床時の病期判定が覆る例は、PSA、GSが大きければ大きいほどその確率も上昇します。
たとえばT2a(病期B1)の場合、PSAが10未満、GS=5程度(中リスク群)なら限局率は約55%ですが、PSAが20以上、GS=8(高リスク群(1))ともなれば、限局率は約5%に急落します。
これで判るとおり臨床病期のみでの判断は危険で、ある程度病理的診断を予測した「リスク群」に基ずく判断の方が合理性が高いと思われます。
全摘術を選択した場合はこういう事態のありうることも理解した上で、あらかじめ医師ともその時の対処法を相談しておくべきでしょう。
一旦麻酔をかけられて手術室に運び込まれたら、あなたにもご家族にも、もうそこは手の届かぬ世界なのですから。
<主な標準治療>
【高リスク群】
・放射線外部照射+長期(2-3年)ホルモン療法
・全摘除術+リンパ節郭清
■
超高リスク群
T3b(精嚢浸潤)~T4(周辺臓器浸潤)の全てと、T3a(浸潤がん)でかつPSA又はGSがハイリスク状態にあるものが、このカテゴリーです。
PSAとGSのハイリスク状態の比較では、GSのほう(低分化がん)が要注意と考えられています。
転移・再発がんを除いて、最も危険度の高いこのクラスは、数年前までは完治が困難と言われていましたが、近年は放射線技術の進歩もあって、
うまくいけば完治も望めるようになってきました。
このカテゴリーでの本命は、やはり外部照射でしょう。
米国で72gy以上の線量とそれ以下の線量の二つのグループで放射線の治療成績を比較した
データがありますが、成績には明らかな差がありますから、少なくとも72gy以上の高線量高精度照射が望まれます。
ホルモン療法の併用は必須です。主治療の前に数ヶ月間ホルモン療法を施すのはほぼ共通しているようですが、
主治療の後ホルモン療法を継続するかどうかには、我国では医療機関によって違いがあるようです。
米国NCCNでは、(超)高リスク群においてはホルモン剤の長期(2~3年)併用が標準とされています。
画像診断で見つけられない(医療技術の限界)「微小な遠隔転移」が潜んでいる場合は完治は望めませんが、
治療前からこうした神のみぞ知る事に思い悩んでみても所詮仕方が無いことです。
「微小転移」があった場合、治療後もPSAは下がりきらず、ホルモン療法をしない限りPSA値はそのまま上昇を続け、
可能な治療法としては、別項(§4)の「転移・再発(再燃)がん」に準じた対応をとらざるを得ません。
私の場合は病期(T3)・PSA(147)・GS(9)の三要素がそろってハイリスクでしたから、
完治が狙える範囲としては、まさにぎりぎり紙一重だったわけですが、2005年に放射線治療(IMRT)を受け、
治療後5年を超えてもPSA再発はなく、がん細胞とのお付き合いもひとまず縁が切れたと信じています。
内心ひそかに心配し続けていた「微小な遠隔転移」によるPSA上昇も出現せず、このことは
初めから微小転移はなかったということなのか・・・あるいは微小転移はあったかも知れないが、併用したホルモン療法が良く効いたせいなのか、
はたまた、体内の免疫活性が微小がんを打ち負かしてくれたせいなのか・・・どれが正しいのかはわかりませんが、
要は私に対して幸運の女神が微笑んでくれたわけです。
T3(病期C)ならばたとえどんなにハイリスクでも、希望をすてずに完治を目指しとことんがんばりましょう!
リスクが高くとも、落ち込んでいてはいけません。始めは顔がひきつっても止むを得ないのですが、常に"笑顔"と"前向きの姿勢"が大事です。
健康食品や民間医療で医学的根拠のあるものはまずありません。そんなものに飛びつくぐらいなら、にこにこ笑って暮らすほうがよほどましでしょう。
笑いは免疫活性を刺激し精神状態を活性化するというのは否定できない事実ですから。
<主な標準治療>
【超高リスク群】
・放射線外部照射+長期(2-3年)ホルモン療法
・全摘除術+リンパ節郭清
・ホルモン療法
注(1) 「リスク群」を用いた分類法について
個人的にはNCCNのこうした分類方法は非常に合理的だと思うのですが、日本では「前立腺がん診療ガイドライン」(2006年版)においても、
ほとんどこ分類法に触れられておりません。「静岡がんセンター」など一部の先進的な医療機関ではこうした新しい分類が試みられているようですが、
全体的にはまだあまり積極的には活用されているとは言えないようです。
注(2) 隠れた浸潤・転移に対する放射線治療について
(超)高リスク群に放射線外部照射を施す場合、画像に表れない浸潤や転移が十分予測されるわけですが、
これに備えて、いったいどういう対応をとっているのでしょう。
あらかじめ、より広範囲の腹部に低目の線量を照射しておくという考え方もあるようですが、
私が受けた治療は、精嚢を含む限局照射だけでした。(注:低リスク群では精嚢はターゲットに含めない)
放射線治療はがん細胞を瞬時に焼き殺すわけではなく、がん細胞、正常細胞のいずれに対してもそのDNAの一部を損傷するというダメージを与えます。
ところが正常細胞のダメージ修復力はがん細胞に勝っており、その修復力の差を利用し、
一回に2グレイ程度の分割照射を繰り返し行うことで、正常細胞を保護しつつがん細胞だけの自滅
(アポトーシス)を狙うわけです。
ところで放射線には細胞にダメージをあたえるのとは別のもう一つの働きがあります。がん細胞は体の免疫システムからうまく逃れていることが多いのですが、
がん細胞に一定以上の少量放射線を当てた場合、がん細胞に「異物」であるという識別札を付ける働きがあることが判って来ました。
(詳しい機序はまだ解明されていないようです)。
免疫細胞に、まだ生き残っている微小ながん細胞が標的であることを認識させ、がん細胞に襲い掛かり死滅させるよう仕向けるわけですが、
実際、放射線をあてた部分に免疫細胞(マクロファージ)が集まる様子が顕微鏡でも確認できるそうです。
我々の体内では、毎日数千のがん細胞の芽が誕生し(細胞分裂時の遺伝子のコピーミスと言われています)、
それを人体に備わった免疫システムでやっつけるということを日々延々と繰り返しています。
ピンポイント照射というのは放射線の集積密度をいかに際立たせてコントラストをつけるかが勝負となってくるわけですが、X線そのものの特性として、
標的を通過する時、標的の前後の放射線をその線上に於いて全て消し去ることは不可能ですから、
近傍の臓器にも健康上問題が出ない程度の放射線が当たることは容認せざるを得ないわけです。
(これに関しては粒子線のほうが優れた物理特性を持っています)
周辺部のがん細胞に対し、標識を付け、免疫システムのスイッチを入れるには、はたしてどの程度の線量が最低限必要なのか、
まだ詳しくはわかっていませんが、こうしたがん細胞が潜んでいるかもしれないファジーゾーンへの「やむを得ない」放射線照射が、案外その役目を果たしているのかも知れません。
骨盤のリンパ節を狙って行われる予防的照射は、結局この免疫スイッチを働かすことにつながっているのではないでしょうか。
これとは別に、従来から経験的に知られている効果としては、限局部の放射線量が多いほど、近傍も含めてがん全体の制御率が向上することです。
病期T3(病期C:浸潤がん)の前立腺がんにおいて、放射線治療の方が全摘術より優位に立てるのはこのあたりの事情に負うところが大きいようです。
粒子線はブラッグピークを持つため(粒子の飛行線上のある一点で大きなエネルギーを放出する。
目標位置の手前では僅かしかエネルギーを放出せず、後ではストンと消滅してしまう)ターゲットを絞り込むコントロール能力は高いのですが、
こうした近傍への波及効果がどの程度あるものかについてはまだX線ほどデータの蓄積がなく、詳しいことは判っていません。
前立腺がんのみならず、乳がんの乳房温存手術においても、たとえ手術で取り残しがあっても放射線をあてれば再発率が明らかに下がることが判っていますが、
これも近傍への免疫促進効果といえるでしょう。
Ⅰ期の非小細胞肺がんでは画像上転移がなくとも、手術ならば30~40%のリンパ節転移が発見されその都度郭清されているわけですが、
放射線治療ではわざわざリンパ照射を行わなくともリンパ節に転移が生じるのは10%程度で、治癒成績は体への負担が大きい手術とほとんど変わりがありません。
これまでは微小な転移があれば「完治は無理」と一概に言われており、逆に完治したなら「微小転移がなかった」という単純な解釈でしたが、
これも「微小な転移はあったかも知れないが、大きながんの消滅により相対的に免疫システムのパワーが増し、微小ながんをやっつけることができた」
と考えるほうが合理的なようです。
私の場合も、遠隔転移が強く疑われていたものの予後5年半(2011/02現在)が無事に経過しているのは、
放射線のおかげで体内の免疫システムが活性化されうまく働いてくれたせいなのかも知れません。
|